טיול לכימיה תיאומית פשוטה: מליטה, שידור חוזר ותוכניות מסלוליות פשוטות
אנא עיין ב תשובת Breaking Bioinformatic לתכנית MO של פחמן חד חמצני, זה מאוד מועיל. תוכלו גם להסתכל בתמונות מסלוליות ב תשובה זו של מרטין. פחמן חד חמצני יכול להיקשר למרכזי מתכת דרך קשר קואורדינטיבי σ כאשר ה- HOMO של $ \ ce {CO} $ מתקשר עם מסלולי מתכת וגם על ידי שידור חוזר π, Breaking Bioinformatics שהוזכר. אתחיל לגעת בקשר σ כדי שנבין בהמשך טוב יותר את הקשר π. באיור 1 ניתן לראות את ערכת המסלול המולקולרית של קומפלקס המורכב מיון מתכתי מרכזי ושישה ליגנדים התורמים באופן σ באופן בלעדי.
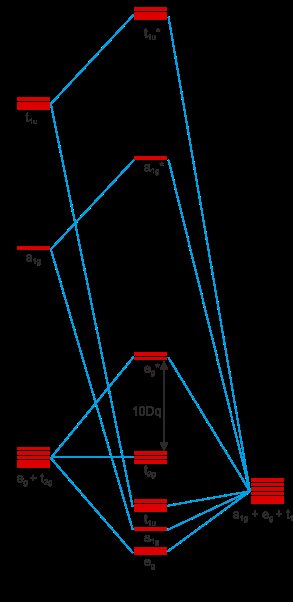
איור 1: תכנית מסלולית מולקולרית של קומפלקס אוקטהדרלי עם שישה תורמים σ סביב מתכת מרכזית. הועתק מ אתר זה ומשמש לראשונה ב תשובה זו שלי. מסלולי מתכת הם 3d, 4s, 4p מלמטה למעלה; מסלולי ליגנד הם מסוג s.
תבחין כי איור 1 מכיל את הייצוגים הבלתי ניתנים להפחתה של האורביטלים שמתחתיהם. אורביטלים יכולים להתקיים רק אם יש להם ייצוגים זהים בלתי ניתנים להפחתה; אחרת, האינטראקציות שלהם יסתכמו באפס. אנו יכולים לראות שהאורביטלים של מתכת d מפוצלים ל $ \ mathrm {t_ {2g}} $ סט ו $ \ mathrm {e_g} ^ * $ סט. זו ההשפעה של קשר σ ומדוע הוא מייצב את כל הישות.
קשירת π יכולה להתרחש רק אם ליגנדים יש מסלולים זמינים של סימטריה π. מסלולי 2π של $ \ ce {CO} $ הם דוגמה נחמדה, אך ניתן גם להניח פשוט הליד עם אורביטלי ה- p שלו לאותו אפקט. בהמשך ב סקריפט האינטרנט המקורי העתקתי את התמונה מ-, תוכלו לראות סט של שתי תמונות המציגות אורביטליות p. שנים עשר מסלולי ליגנד מסוג P יהפכו ל $ \ mathrm {t_ {1g} + t_ {1u} + t_ {2g} + t_ {2u}} $ , ובכך אינטראקציה מייצבת / מייצבת נוספת מוצגת עבור $ \ mathrm {t_ {2g}} $ אורביטלים. עקב המסלול $ 2 \ unicode [Times] {x3c0} ^ * (\ ce {CO}) $ הדומה באנרגיה למתמטיקה $ \ mathrm {t_ {2g}} $ ו ריק, הם יכולים לייצב את הקוד היטב, וליצור ייצוב חזק אולי למערכת הכוללת. מכיוון שמדובר באינטראקציה של שני אורביטלים היוצרים אורביטלים מקשרים ונוגדים, ומכיוון שהמסלול המולקולרי שנוצר מתמלא בשני אלקטרונים הנובעים ממרכז המתכת זה מכונה π-backbonding.
מצב הקישור של פחמן חד חמצני להמוגלובין
לאחר דיון רקע נרחב זה, ייתכן שיהיה ברור ש $ \ ce {CO} $ הוא בדרך כלל ליגנד טוב. מסיבות שלא נכנסתי אליהם, קומפלקס קרבוניל של יונים מתכות הוא לא כל כך יציב, אבל ליגנד קרבוניל בודד יהיה כמעט תמיד מועיל. כך קורה למערכת הפורפירין-ברזל (II) היוצרת את לב ההמוגלובין: יון הברזל המרכזי (II) מתואם היטב מחמישה כיוונים (ארבעה מטבעת הפורפירין והיסטידין אחד של המוגלובין) ובעל קשר חלש אטום מים במצב הקרקע במשבצת התיאום השישית שלו, לפעמים נעקר על ידי היסטידין דיסטלי. פחמן חד חמצני יכול להתפזר ולהיקשר היטב למערכת זו, תוך עקירת מים קשורים חלש והיסטידין. למעשה, האם מבודד יכול לקשור פחמן חד-חמצני $ 10 ^ 5 $ טוב יותר מכך שהוא יכול לחמצן.
זה דבר שהטבע לא באמת יכול היה לעכב. , מכיוון שהוא מבוסס על תכונות בסיסיות, אך גם על מה שהטבע לא ממש דאג לו, מכיוון שהריכוז הטבעי של פחמן חד חמצני נמוך מאוד, והטבע לעיתים נדירות נאלץ להתמודד עם זה בעיכוב תחרותי של קשירת חמצן להמוגלובין.
מצב הקישור של חמצן להמוגלובין
חמצן, המולקולה $ \ ce {O2} $ , הוא תורם σ נמוך מאוד - במיוחד בהשוואה ל $ \ ce {CO} $ . תוכנית המסלול המולקולרית שלו היא בדרך כלל זו של פחמן חד-חמצני, אלא שהיא סימטרית לחלוטין ושני אלקטרונים נוספים נכללים: הם מאכלסים את מסלולי 2π כדי לתת מצב קרקע משולש. אורביטלים אלה הם כעת ה- HOMO והם כמעט לא משתרעים לחלל בצורה משמעותית יותר - בנוסף לזוג הבודד שעדיין קיים בכל אטומי חמצן נמצא כעת באנרגיה נמוכה בהרבה וגם אינו משתרע לחלל ולכן אינו יכול להיקשר למרכז מתכת בתוך באופן σ.
מה שקורה כאן מורכב למדי, וההרצאה האחרונה ששמעתי בנושא אמרה בעצם כי טרם הובאו ראיות סופיות סופיות. Orthocresol דן בפירוט בנקודות המבט השונות ב שאלה זו. התכונות הדיאמגנטיות של המתחם שנוצר אינן מוטלות בספק ולכן חייבים להניח מצב קרקע יחיד או כזה בו צימוד אנטי-מגנטי מגביל כל סיבוב ברמות מולקולריות. מכיוון שבמצב הקרקע של ההמוגלובין יש מרכז ברזל בעל ספין גבוה (II) ומצב הקרקע של החמצן הוא שלישייה פרמגנטית, הגיוני להניח ששניים אלה הם המתחרים הראשוניים.
פרופסור קלופרס קובע כעת את הצעדים הבאים:
-
הברזל (II) נמצא במצב ספין גבוה עם ארבעה אלקטרונים לא מזווגים;
-
חמצן משולש פרמגנטי מתקרב ואחד מ $ \ unicode [Times] {x3c0} ^ * $ קואורדינטות מסלוליות למגהץ מרכז (II) בצורה σ.
-
זה גורם למעבר בעל ספין נמוך בסיבוב גבוה על ברזל ומארגן מחדש את כדור הליגנד (מקרב חמצן למרכז הברזל) . כעת יש לנו מרכז ברזל יחיד (II) בעל ספין נמוך וחצי קשר σ קואורדינטיבי מחמצן. אנו יכולים לייחס את האלקטרון למרכז הברזל.
-
באמצעות שילוב לינארי, אנו יכולים להתאים את מסלול σ נושא הספין ואת מסלולי הברזל המאוכלסים כך שנוצר מסלול שיכול ליצור אינטראקציה עם אחר $ \ unicode [Times] {x3c0} ^ * $ של חמצן בצורה π.
-
לפיכך אנו מצפים לצימוד אנטי-מגנטי ומצב כולל שניתן לתאר בצורה הטובה ביותר כ $ \ ce {Fe ^ {III} - ^ 2O2 ^ {.- }} $ span> - חמצון פורמלי של אלקטרון אחד של ברזל לברזל (III), הפחתת חמצן לסופר-חמצני ( $ \ ce {O2 -} $ ) .
-
אם מטפלים במסלולי נושא הספין כולם כמרכזי מתכת, אנו מקבלים $ \ ce {Fe ^ {II} - ^ 1O2} $ מדינה.
(התוכן בקישור שציטטתי ממנו הוא בגרמנית; התרגום שלי וקוצר מהמקור. )
רק בגלל כדור הליגנד המכוון מורכב וגם בגלל המעבר המייצב בספין נמוך עם ספין גבוה (בתוספת ארגון מחדש) חמצן מסוגל להיקשר לברזל בכלל . ההיסטידין הדיסטלי מייצב עוד יותר את המתחם על ידי קשר מימן, ומקל על המטען מעט. יש להניח שהטבע ביצע הרבה כוונון לאורך האבולוציה שכן התהליך כולו מורכב למדי ומותאם היטב לאיסוף חמצן במקום בו הוא נמצא בשפע (בריאות) ולשחררו ברקמות בהן הוא נדיר. / p>
השוואה בין מצבי הקישור לחמצן ופחמן חד חמצני
התמונה הפשוטה יותר שציירתי לעיל לפחמן חד חמצני אינה נכונה. בתוך המוגלובין, פחמן חד חמצני גם נקשר בצורה זוויתית כאילו היה חמצן - ראו תשובת bonCodigo למודלים אטומיים שממלאים חלל. הסיבה לכך היא שכיס הכריכה כולו מיוצר כדי לאפשר חמצן להיקשר (כפי שציינתי) ובכך מנסה הכל כדי להפוך חמצן לבית נוח. פחמן חד חמצני די מתוח שם, הזיקה המחייבת שלו מופחתת בגורם של $ 1000 $ . עם זאת, מכיוון שהתחלנו בהפרש זיקה מחייב של 10 $ ^ 5 $ , פחמן חד חמצני עדיין יכול לקשור 100 $ $ span> פעמים טוב יותר מכפי שיכול חמצן.
סיכום
-
חד תחמוצת הפחמן הוא בדרך כלל ליגנד טוב שיכול להיקשר היטב למרכזי מתכת.
-
חמצן הוא בדרך כלל ליגנד ירוד.
-
הטבע עשה הכל כדי להפוך חמצן לבית נוח בהמוגלובין.
-
בכך, כיס הכריכה הפך ל משמעותית פחות נוח ל $ \ ce {CO} $ .
-
אך מכיוון שפחמן חד חמצני היה כל כך טוב וחמצן כל כך גרוע מלכתחילה, הראשון עדיין נקשר טוב יותר מזה האחרון.
-
הטבע לא ממש היה אכפת להם, כי לעתים רחוקות אנשים באים במגע עם פחמן חד חמצני ולכן נלקחו בחשבון את הנזק הבטחוני.